
私たちの身の回りにある物は、全て小さな原子や分子が集まって構成されています。
多くの物質は触っただけでバラバラになるようなことはなく、何らかの強い力でくっついていることが想像できます。
そこで今回は、物質同士(原子・分子同士)がどのようにくっついているのか、について考えていきたいと思います。
原子の基本
まずは物質を構成する原子について理解してもらう必要があります。
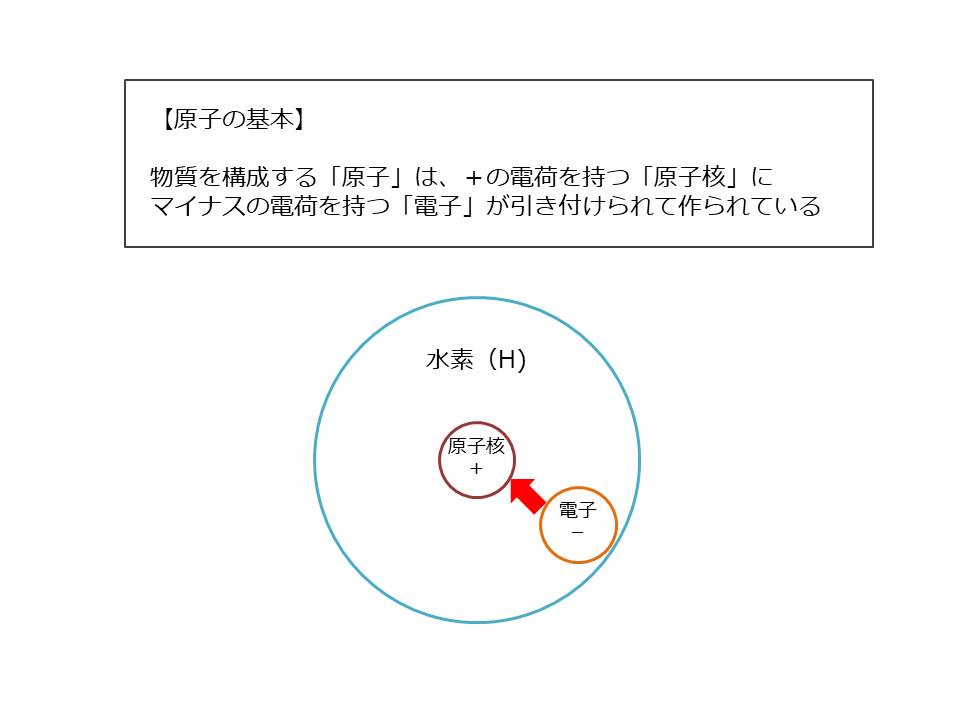
原子は、中心にプラスの電荷(電気的な力)を持つ「原子核(※)」があり、それに、マイナスの電荷を持つ「電子」が引き付けられることで作られています
この原子核のプラスが電子のマイナスを引き付ける力(クーロン力と呼びます)が、原子・分子同士がくっつく上で非常に重要な力となっています。
※原子核は、電気的に中性の中性子と、電気的にプラスの陽子で作られており、原子核全体としてはプラスの電荷を持ちます。
この基本を押さえていただた上で、以下から、原子や分子の結合について解説していきます。
<共有結合>
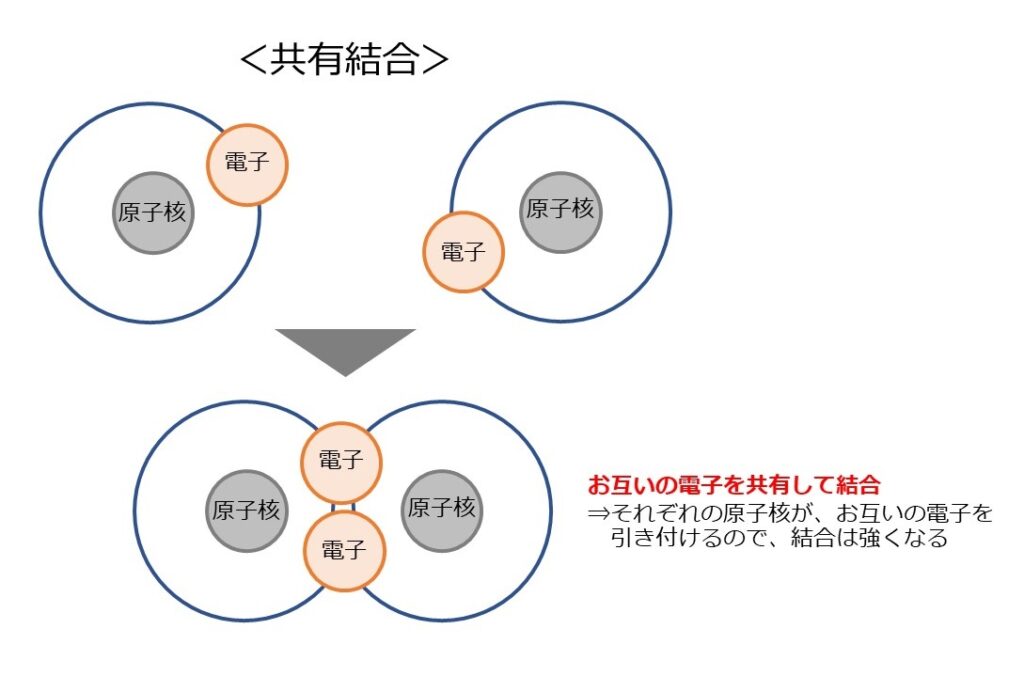
1つ目のくっつき方(結合の方法)は「共有結合」です。
原子同士がそれぞれの電子を自分の原子核で引き付け、電子を共有することで結合しています。
結合の方法としては、最も強い結合となります。
<イオン結合>
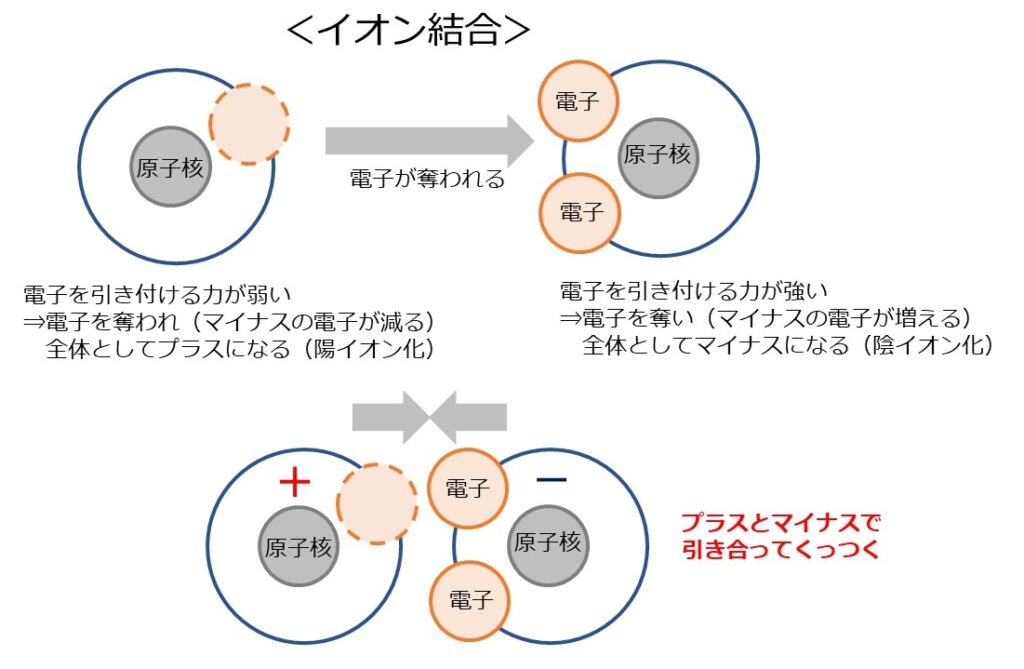
2つ目の結合の方法は「イオン結合」です。
原子は、その種類によって原子核が電子を引き付ける力が異なります。(※)
電子を引き付ける力が強い物質と、電子を引き付ける力が弱い物質が近づくと、引き付ける力が強いほうに電子を奪われてしまいます。
電子を奪った物質は、1個余分に電子(マイナス)を持つこととなるため、原子全体として「マイナス」となります。
一方、電子を奪われた物質は1個電子(マイナス)が少ない状態となるため、原子全体として「プラス」になります。
※原子核が電子を引き付ける力を「電気陰性度」と呼びます。
電気陰性度は、原子核に含まれる陽子(プラス)の数や、原子核と電子との距離などで決まります。
イオン結合で有名なのは、ナトリウム(Na)と塩素(Cl)が結合した塩化ナトリウム(NaCl・食塩)です。
ナトリウムは電子を引き付ける力が弱いため電子を奪われ、プラスの陽イオンに、
塩素は電子を引き付ける力が強いため電子を奪い、マイナスの陰イオンになり、イオン結合します。
<金属結合>
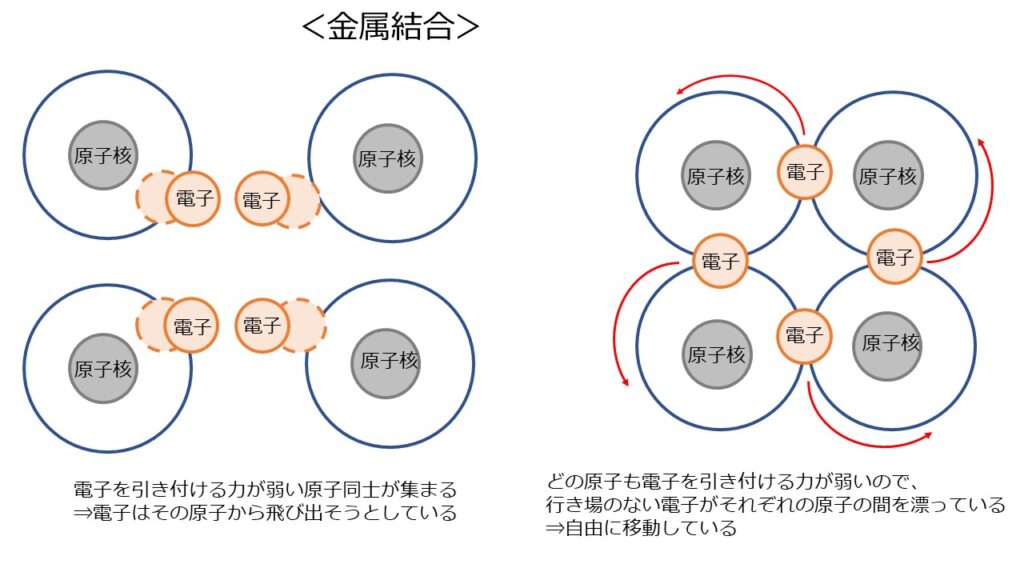
3つ目の結合の方法は「金属結合」です。
これは、電子を引き付ける力が弱い原子同士が集まった時に起こる結合です。
電子を引き付ける力が弱い原子は、電子が外に飛び出そうとしています。
しかし、周りに電子を引き付ける力が強い原子がないため、行き場を失った電子は、それぞれの原子の間を、場所を決めることなく漂うことになります。
これはつまり、結合した物質内を電子が自由に動ける(自由電子がある)ということを意味しています。
アルミニウム、鉄、銅などは電子を引き付ける力が弱いことからこの金属結合で結びついており、その結果として、電気を通すことができるのです。
<水素結合>
4つ目の結合は「水素結合」です。
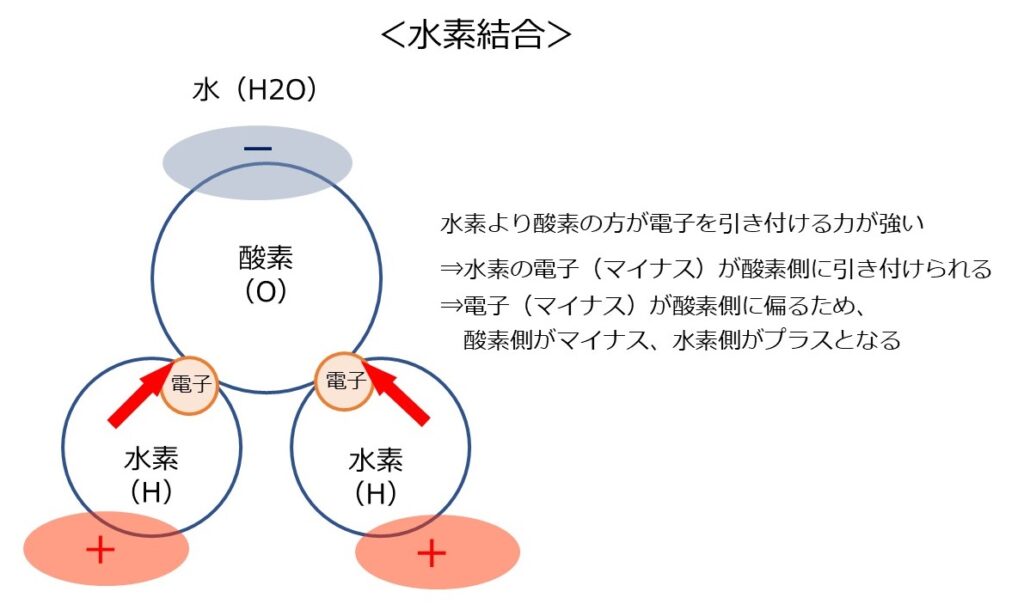
電子を引き付ける力が弱い原子と電子を引き付ける力が強い原子が共有結合して分子を作ったとします。
もともと電子を引き付ける力が弱い原子が持っていた電子は、全体的に引き付ける力が強い原子の方に引き寄せられます。
その結果、分子全体としては、電子を引き付ける力が弱い側がプラス、電子を引き付ける力が強い側がマイナスとなります。
この分子が同じ状態の他の分子と近づくと、マイナスの部分とプラスの部分が引き合って結合します。これが「水素結合」です。
下の例では、代表的な水素と酸素が結合して水分子になる例を説明しています。
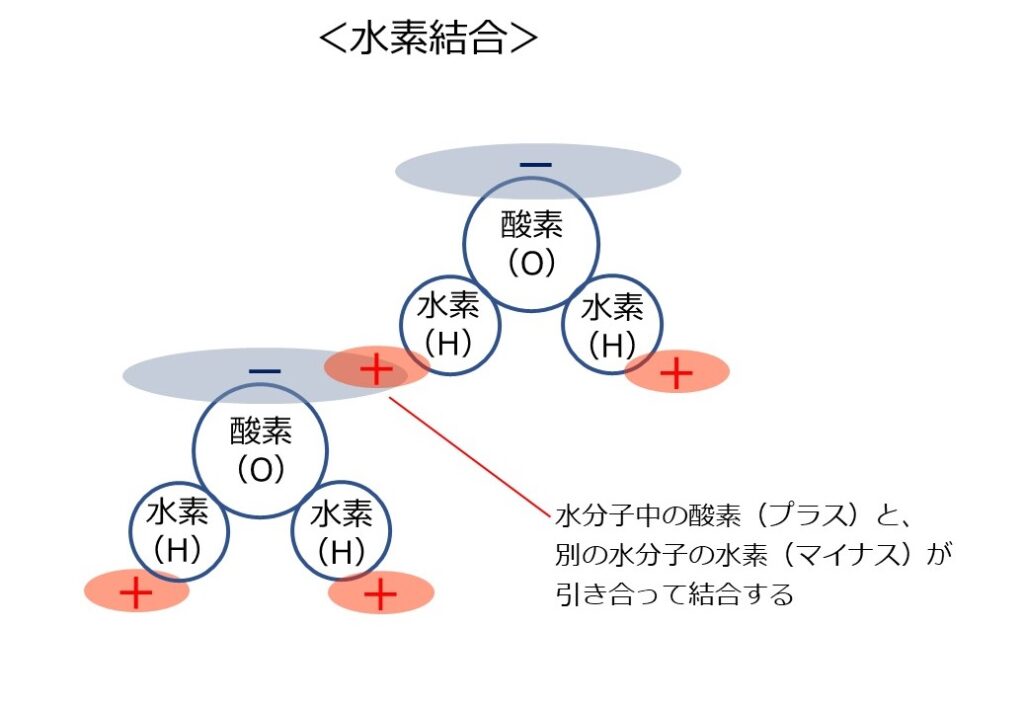
水が固まって水滴になったり、表面張力としてこぼれずに固まったりするのは、この「水素結合」が起こるためです。
<ファンデルワールス力>
次に、「ファンデルワールス力」による結合を説明します。
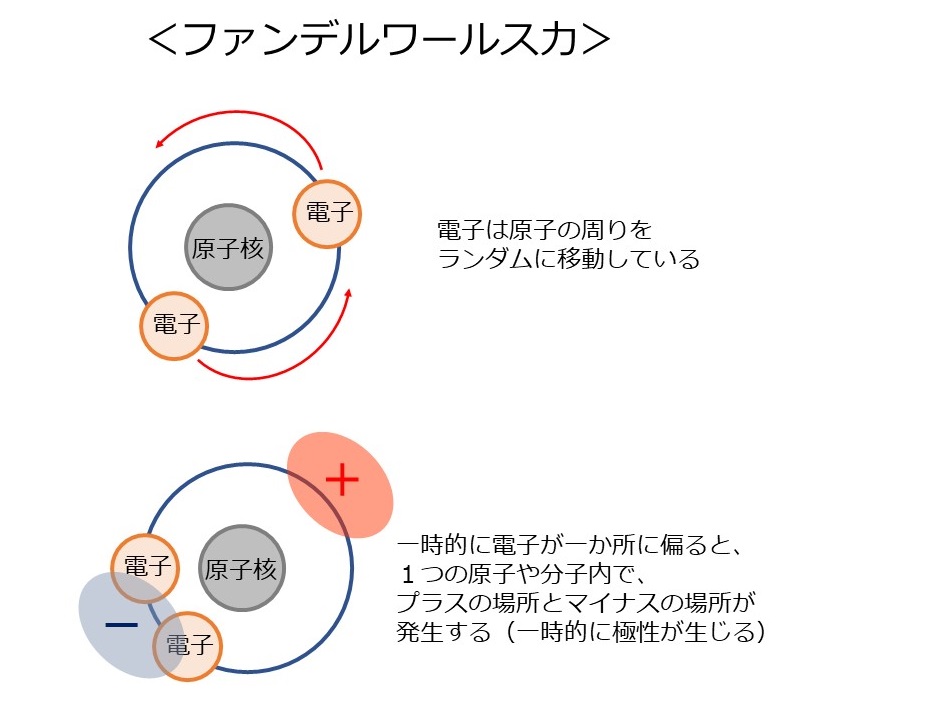
全ての原子・分子において、電子は原子核の周囲をランダムに移動しています。
そこで、偶然、一時的に電子が一か所に偏ることがあります。
その瞬間、その原子・分子において、プラスの箇所とマイナスの箇所が発生します。(電子が偏って存在している箇所がマイナス)
この一時的な偏りによって生じたマイナスの箇所と、別の原子・分子のプラスの箇所が引き合ってくっつく力が「ファンデルワールス力」です。
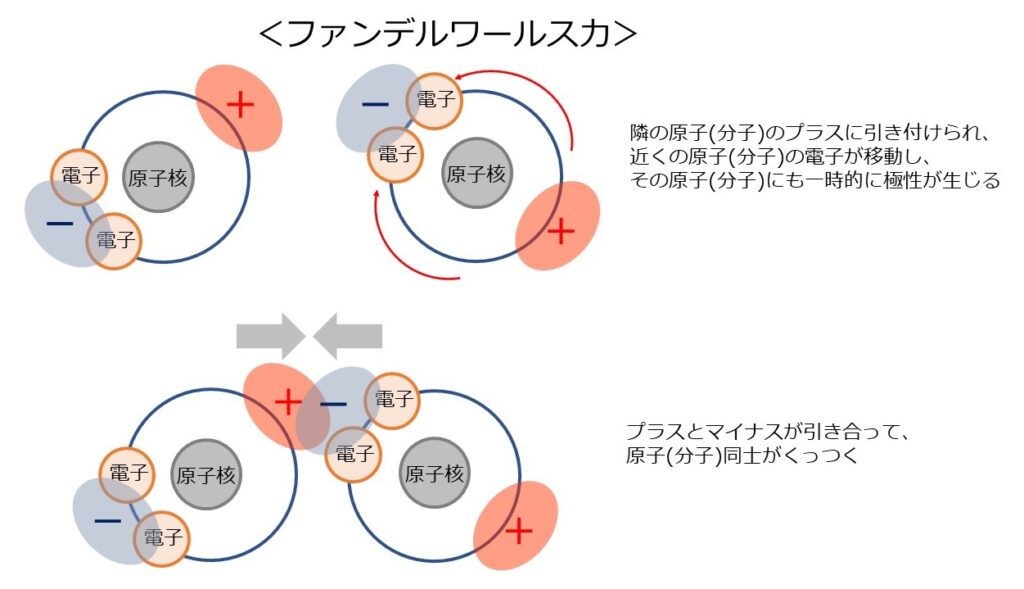
ファンデルワールス力は「分子間力」とも呼ばれ、全ての原子・分子に生じる力ですが、前述の4つの結合と比べると非常に弱い力です。
摩擦力の1つの要因とも言われます。
原子・分子レベルでの結合については以上となりますが、
以下、もう少し大きな視点で物質がくっつく要因を紹介します。
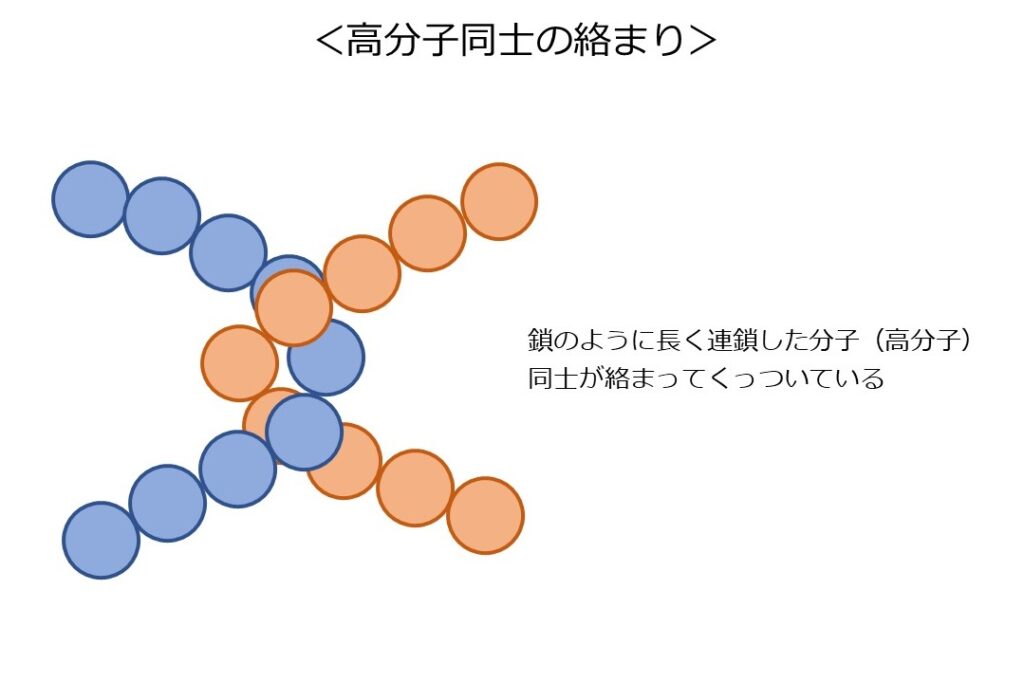
<高分子のからまり>
プラスチックのもととなる樹脂や、はちみつに含まれるブドウ糖(グルコース)という物質は、非常に多くの原子が集まって分子を作っています。
これを「高分子」と呼びます。
高分子は鎖のように長いため、以下の図のように、物質内で絡み合います。これにより、簡単に離れることがありません。
先ほど紹介した樹脂やハチミツがドロッとしてなかなか下に落ちないのは、こうした高分子同士の絡まりがあるためです。
<凸凹のひっかかり>
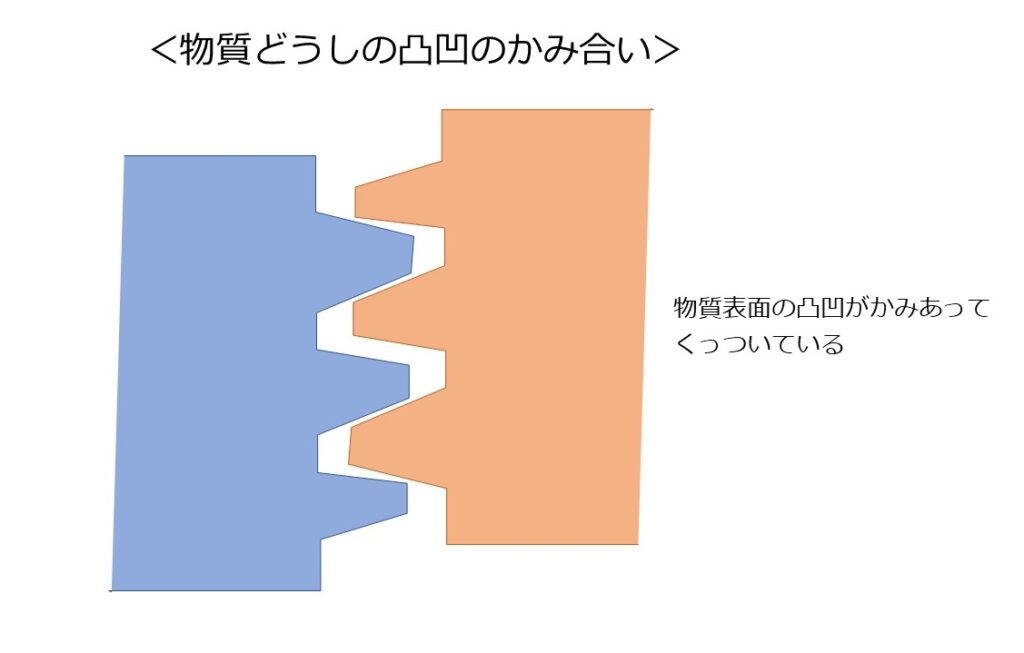
最も大きい視点で物質同士のくっつく要因を考えると、
「物質同士の凸凹のかみ合い」ということになります。
紙のように一見滑らかに見える物質でも、拡大すると凸凹があります。
その物質同士をくっつけることで、歯車のように凸凹がかみ合ってくっつく、ということです。
ざらざらした壁にものがくっつくことがあるのはこの要因でしょう。
なお、かつてはこの凸凹のかみ合いが摩擦力の要因であると言われたこともあったようですが、滑らかな物質同士の方が摩擦力が高まることがあることから、現代では前述の「ファンデルワールス力」が摩擦の主要因であると考えられているようです。
以上、物質(原子・分子)同士がどのようにくっついているか、ということについて説明してまいりました。
金属結合が電気を通す理由になっていたり、水素結合が表面張力の理由となっているなど、今回説明した結合の方法は、物質の特徴を決める上でも重要なポイントとなっています。
よって、今後、様々なギモンを説明する上でこの結合の方法は避けて通れないこととなりますので、ぜひ、覚えておいてください。
