
「何かを動かす」などのきっかけになる存在を「エネルギー」と表現しますが、
このエネルギーという言葉は「仕事をする能力(≒他の物質に何か影響を与える)」と定義されます。
電気がものを動かしたり、熱が水を沸騰させたりする点から、
電気や熱がエネルギーを持つ、というのは直感的にも想像しやすいでしょう。
(別記事で、電気は「電子の動き」、熱は「原子や分子の運動」と説明もしました。)
一方で、炎を出してものを燃やしたり、私たちが体を動かしたりするためにもエネルギーが使われているわけですが、この場合の元となるエネルギーは「化学エネルギー」と呼ばれています。
化学エネルギーというのは
「原子や分子が化学結合内で物質が保有するエネルギー」
と定義されますが、直感的には非常に分かりにくいものとなっています。
そこで今回は、「化学エネルギー」とは何か、ということを説明していきます。
まず、化学エネルギーの基となる、原子・分子の構造について、水素を例に説明します。
水素原子は、+の電荷(電気的な力)を持つ原子核と、-の電荷を持つ電子1個が引き合って存在しています。そして、その原子と原子が電子を共有してくっついているのが水素分子となります。
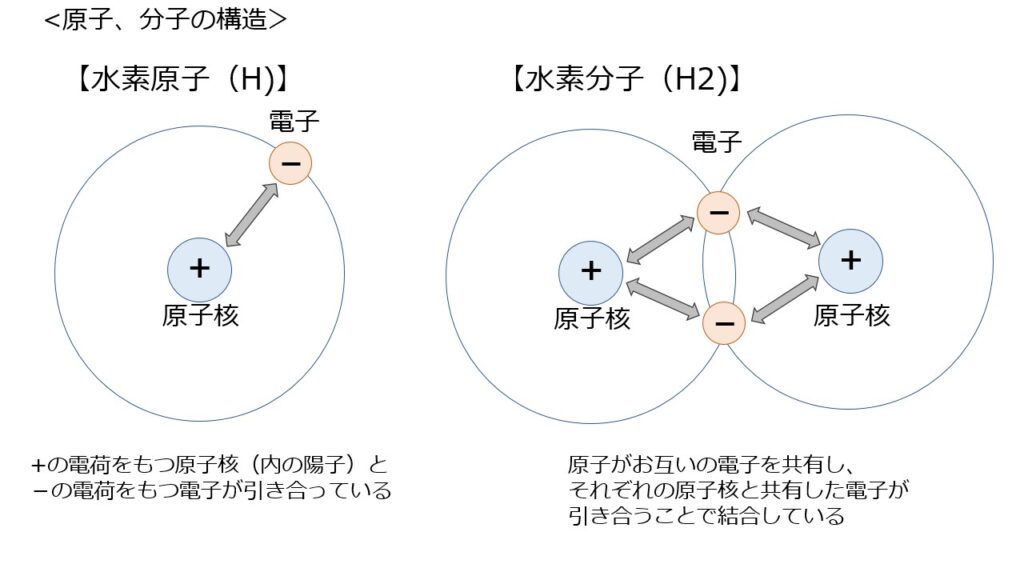
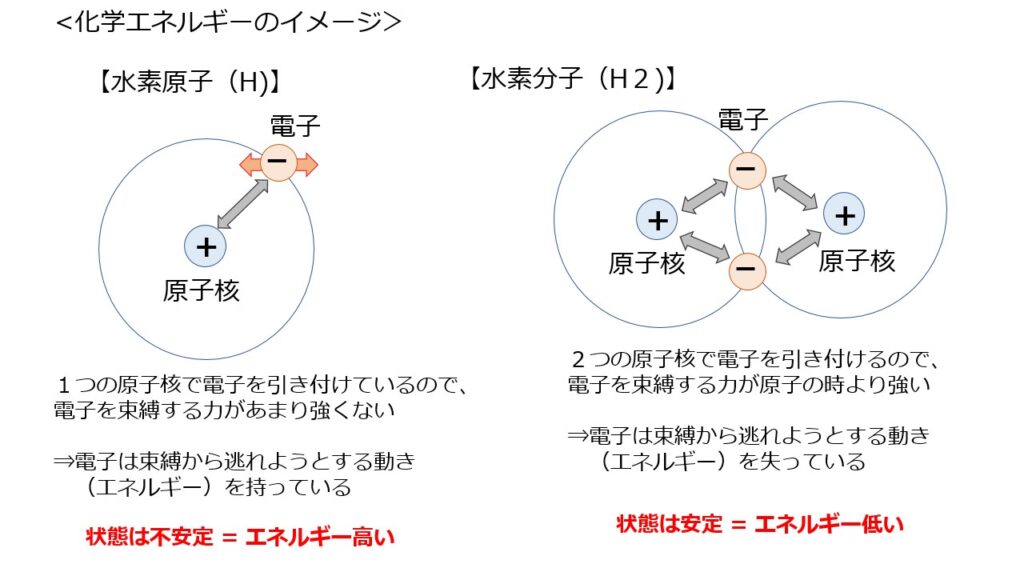
電子は原子核のまわりをランダムに動いていると考えられていますが、水素原子においては、電子を引き付ける力(=束縛する力)は、1つの原子核なのでそこまで強くありません。
よって、電子は束縛から逃れようとする動き(エネルギー)を持っている状態です。
⇒化学的にはこのような状態を「不安定である」といい、不安定なほど、エネルギーが高いとされます。
一方、水素分子においては、電子を2つの原子核で引き付けるため、束縛する力は原子の時より強くなります。電子は束縛から逃れようとする動き(エネルギー)を失い、強く結合している状態となります。
⇒化学的にはこの状態を「安定である」といい、安定であるほど、エネルギーは低いとされます。
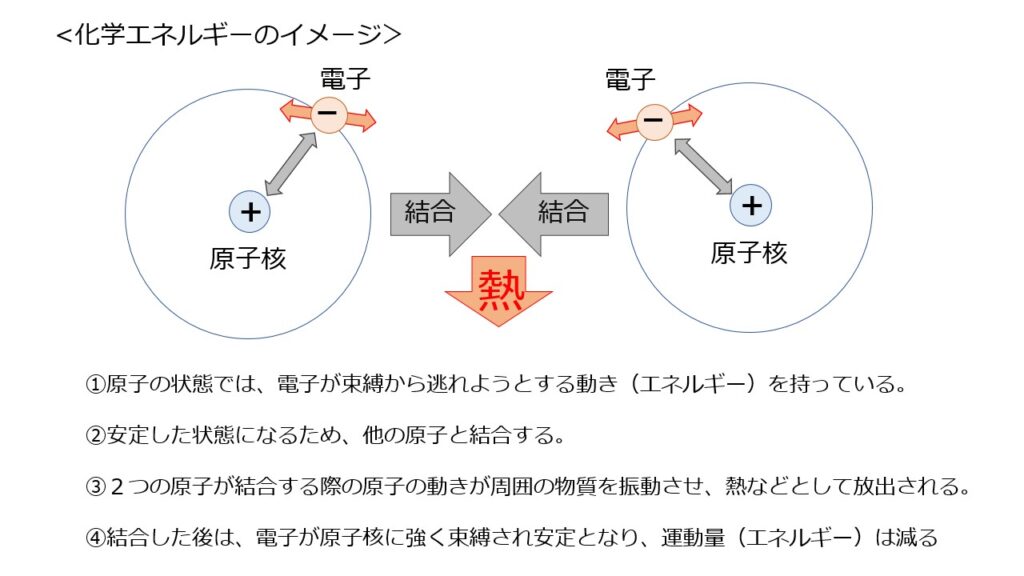
続いて、原子等が持つ化学エネルギーが熱エネルギー等として放出されるイメージを説明します。
物質は「安定な状態をとりたがる」性質があります。
これは、周囲に自分のエネルギーを与え(奪われ)自身はエネルギーの低い状態になる、と言い換えることもできます。
その性質により、水素原子は近くに他の水素原子があると結合しようとします。
不安定な状態である原子同士が結合すると、電子を束縛する力は原子の時より強くなり、束縛から逃れようとする動き(エネルギー)を失います。
この結合する際の原子の動きが周囲の物質を振動させることで、熱エネルギーとして放出されるのです。
以上、化学エネルギーとは何か、ということと、その具体例として燃焼を説明しました。
次回はその化学エネルギー放出の具体例として、「ものが燃える仕組み」を説明したいと思います。
念のため補足ですが、ここでは、極力イメージしやすい表現を使っており、
実際には科学的にはまだ不明確な点や、実際の状況とは異なる点もあることにご留意ください。
