
みなさんもよく使っている「電池」
当たり前に使っていますが、コンセントにつないでいないのに電気が流れるというのを不思議に思ったことはないでしょうか。
そこで今回は、電池の仕組みと原理について説明してみたいと思います。
電池の種類
電池は大きく分けて2種類の電池があります。
1つは「一次電池」と呼ばれ、一度使い切ったらそれで終わりの電池です。普段よく使う乾電池などはこの一次電池ということになります。
2つめは「二次電池」と呼ばれ、充電をすることで繰り返し使える電池です。スマホや電気自動車のバッテリーなどはこの二次電池が使われています。
一次電池の仕組み
まずは、一次電池の仕組みについて説明します。
前提として、電気が流れるというのは、物質中の自由電子が動くことで生じる、ということは押さえておいてください。
(詳細はコチラ→電気とは何か)
一次電池は簡単に言うと「化学反応で自由電子を動かす」ものです。
もう少し丁寧に言うと、
「自由電子を発生させる化学反応」から、
「自由電子を吸収する化学反応」に、自由電子を受け渡すことで電気を発生させます。
具体的な例を見ながら説明していきましょう。
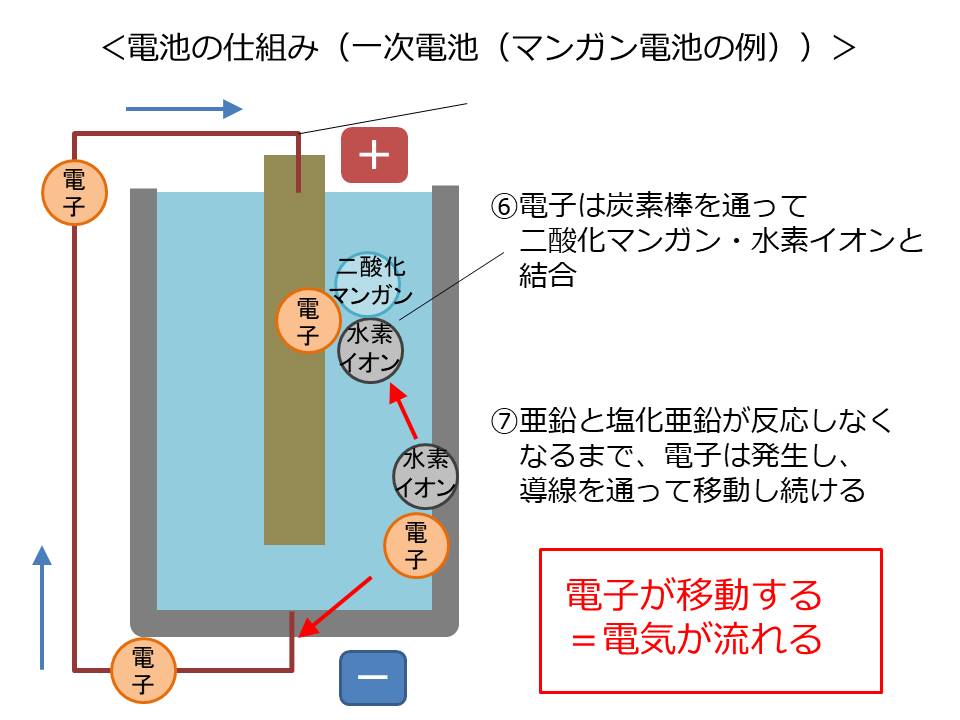
乾電池として使われる、「マンガン電池」を例に説明します。
マンガン電池は、外側に亜鉛の缶、中心に炭素の棒、その間を塩化亜鉛・二酸化マンガン・水の混合液で満たされています。
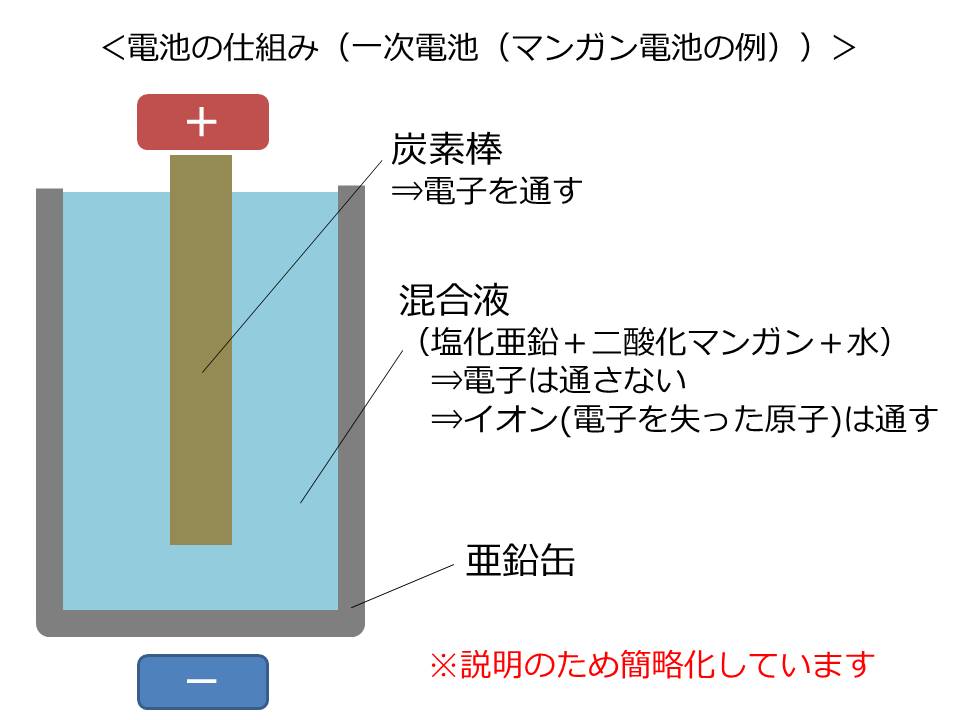
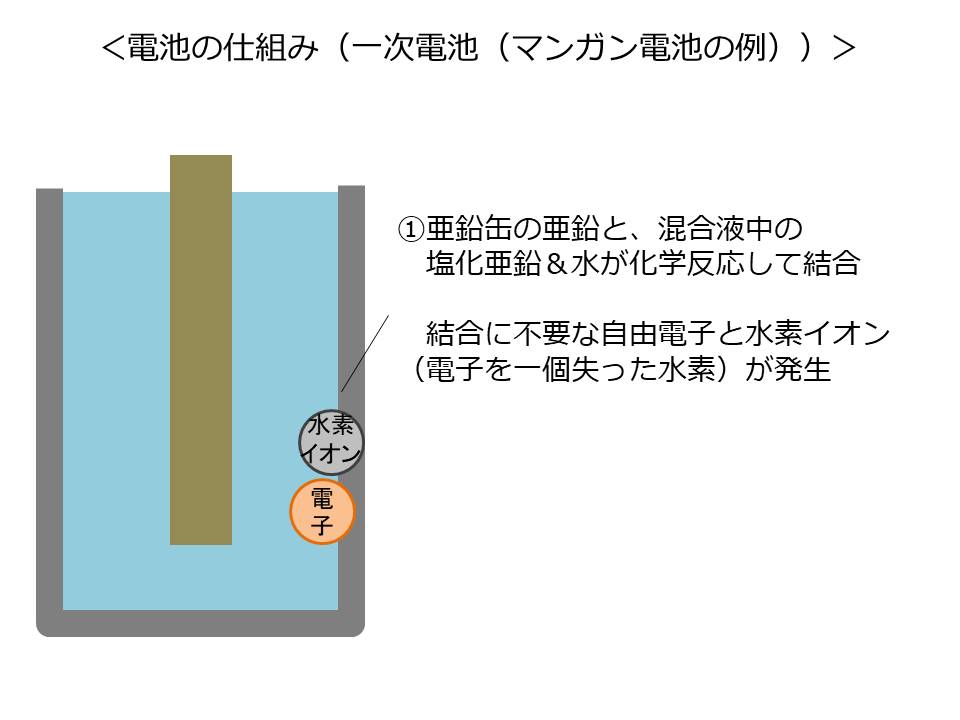
まず、亜鉛缶の亜鉛と、混合液中の塩化亜鉛&水が化学反応し結合します。
その際に、結合においては不要となる自由電子と水素イオン電子を1個失った水素)を放出します。
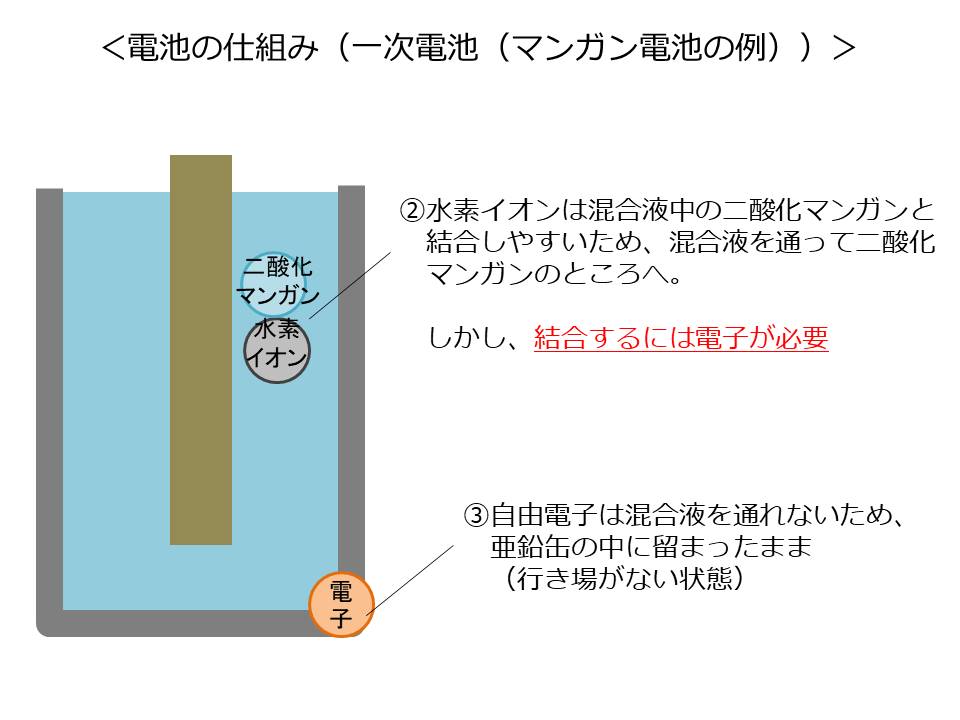
放出された水素イオンは、二酸化マンガンと結合しやすい物質のため、混合液を通って、混合液中の二酸化マンガンのほうへ移動します。しかし、結合には電子が必要なため、まだ結合はしません。
一方放出された自由電子は混合液を通れないため、行き場なく、亜鉛缶の中に留まったままとなります。
この状態で、導線で亜鉛缶と炭素棒をつなぎます。
導線&炭素棒は自由電子が通ることのできる道となります。
水素イオンは電気的にプラスなので、電気的にマイナスである電子はそっちに引っ張られて移動を始めます。
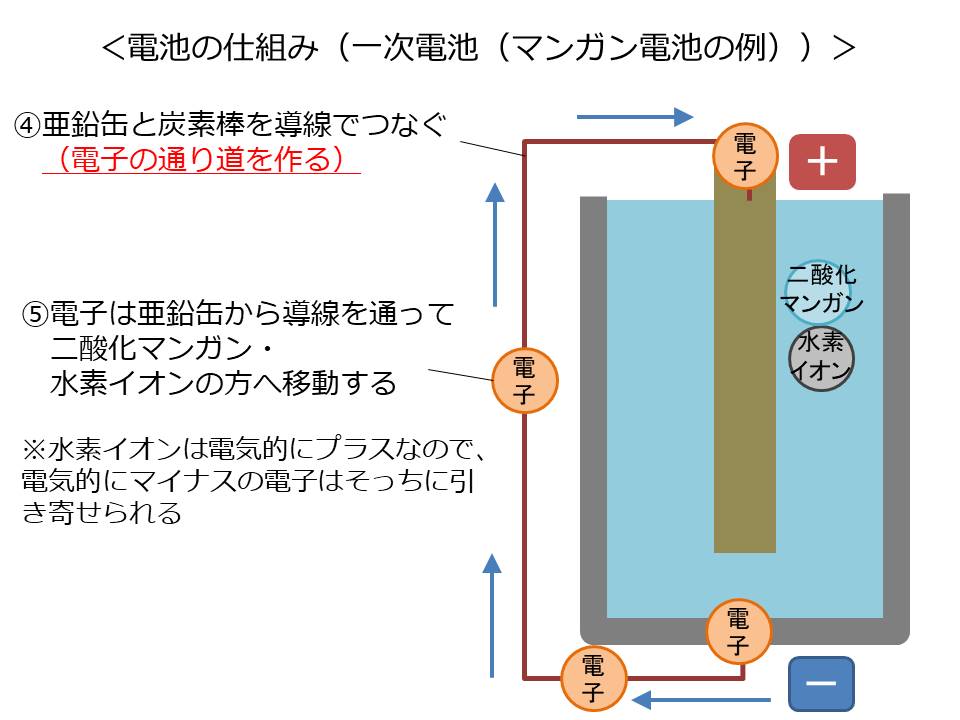
電子は導線&炭素棒を通って二酸化マンガン・水素イオンと結合します。
亜鉛と塩化亜鉛が反応し続ける限り、自由電子が発生し放出され続けるので、その間は電気が流れる、ということになります。そして、反応する亜鉛と塩化亜鉛がなくなると、自由電子の放出が止まるため、電池切れ、ということです。
一次電池にも様々な種類がありますが、化学反応する物質が違うのみで、基本的な原理はどれも同じです。
二次電池の仕組み
続いて、充電可能な二次電池の仕組みを説明します。
電子は外部からのエネルギーを受けることで、原子の束縛から逃れ、自由電子になることがあります。(詳しくはコチラ→電気の仕組み)
二次電池の代表であるリチウムイオン電池は、それを利用し、電子をもった物質に電圧をかけることで、電子を移動させ、充電↔放電を繰り返す仕組みとなっています。
リチウムイオン電池は、コバルト酸リチウムと黒鉛を電解液に付けた構造となっています。
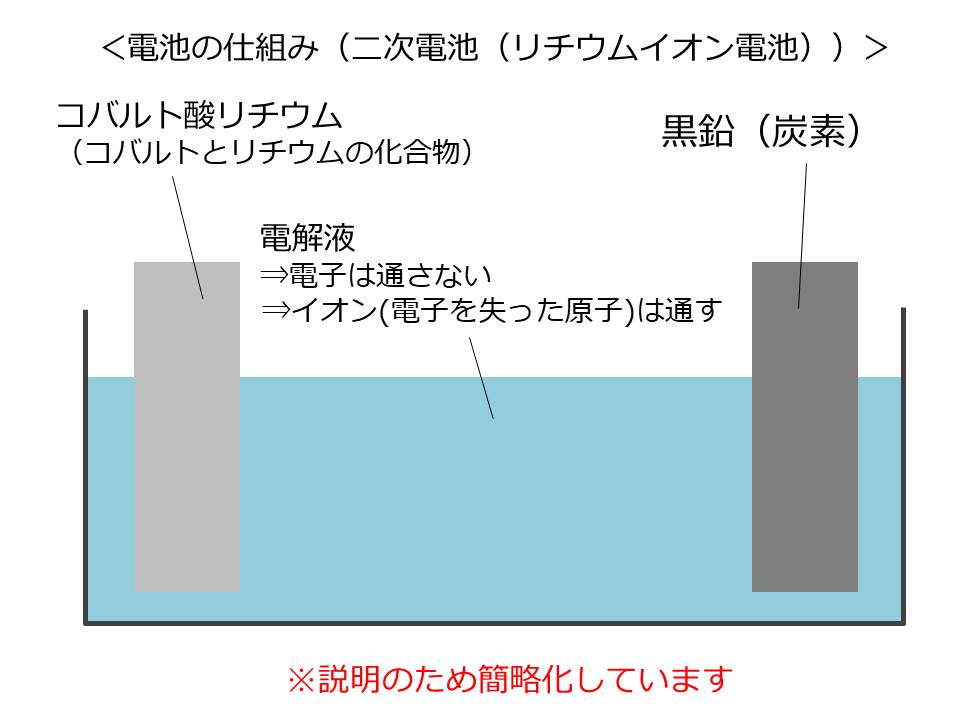
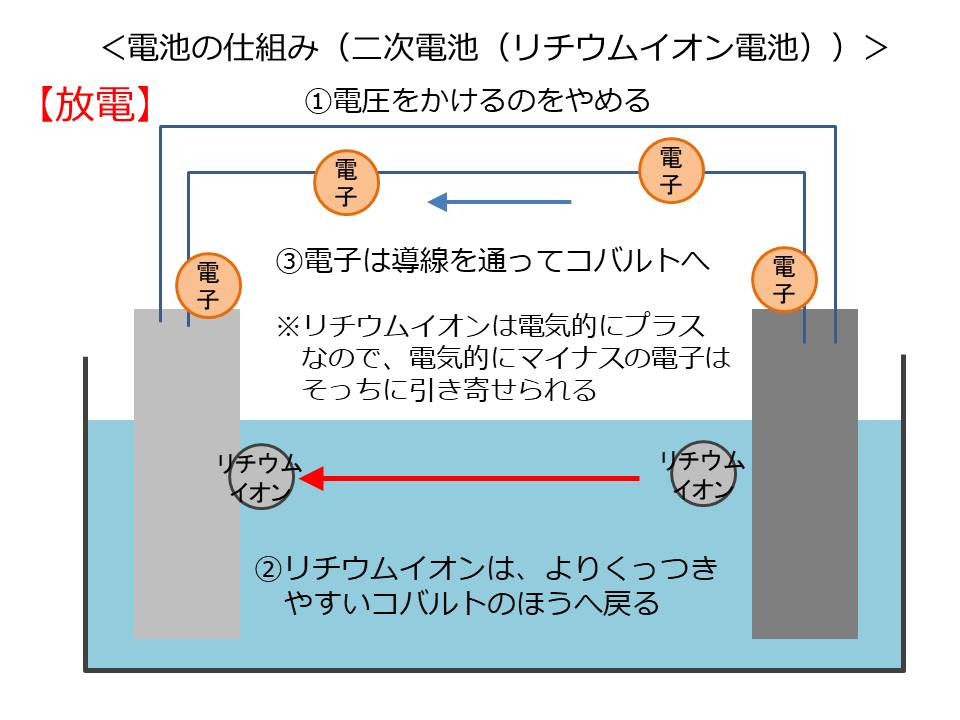
まずは、充電の仕組みを説明します。
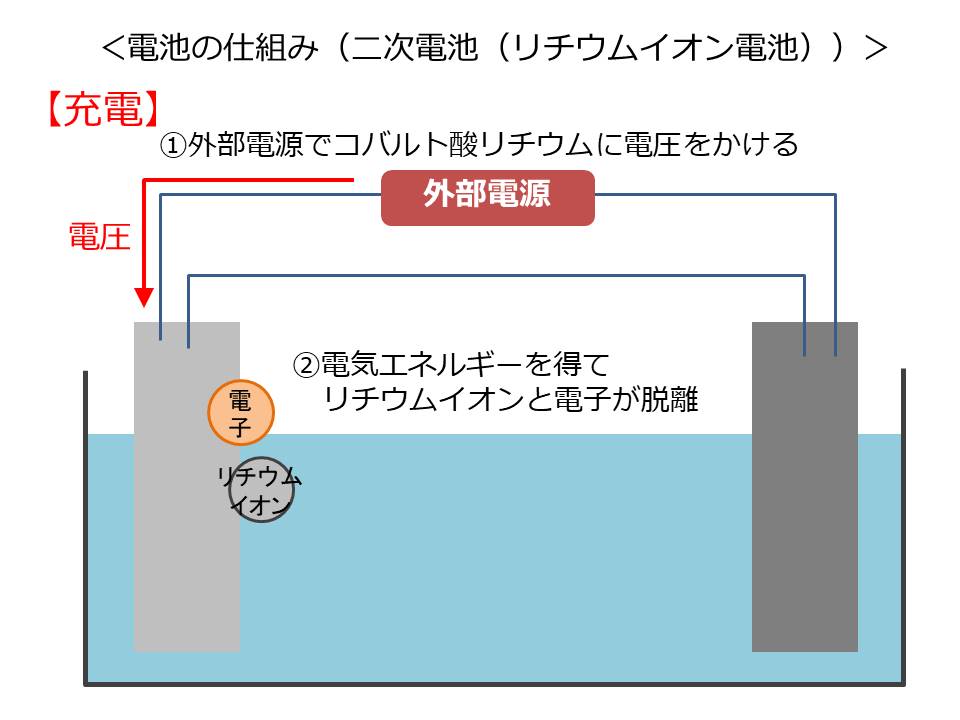
外部からコバルト酸リチウムに電圧をかけると、リチウムイオンと電子がコバルト酸リチウムから脱離し、放出されます。
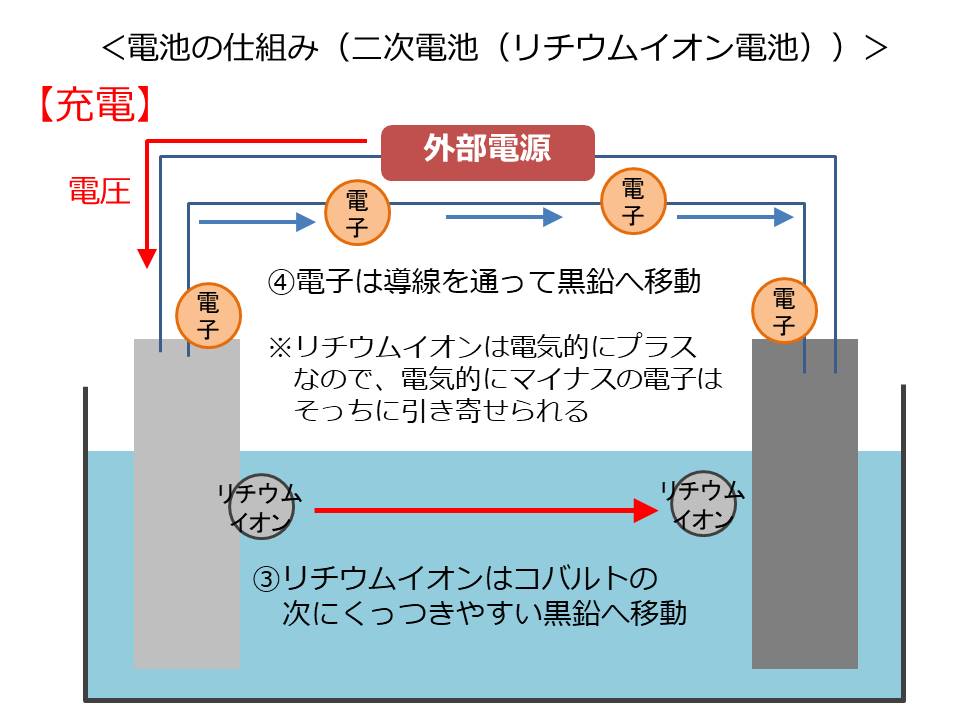
コバルト酸リチウムから脱離したリチウムイオンは、コバルトの次にくっつきやすい黒鉛のほうへ移動します。リチウムイオンは電気的にプラスなので、電気的にマイナスの電子はそっちに引っ張られ、導線を通って黒鉛の方へ移動してきます。
黒鉛は層と層の間に電子を貯められる構造になっており、移動してきた電子を貯留します。
これで充電が完了です。
ここで電圧をかけるのをやめると、リチウムイオンはよりくっつくやすいコバルトの方へ自然と戻っていきます。リチウムイオンに合わせて、電子も導線を通って黒鉛からコバルトの方へ移動していきます。
これが放電です。
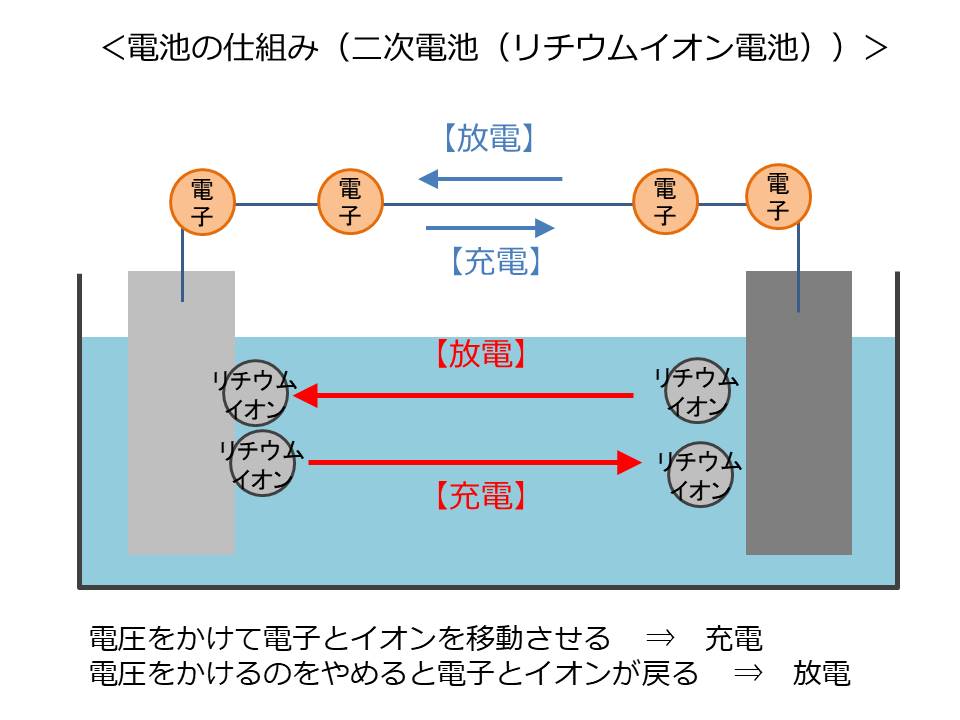
つまり、電圧をかけて無理矢理電子を動かすのが「充電」
電圧をかけずに自然に電子が移動するのが「放電」
ということで、外部からの電気の力を使ってこれを繰り返すのが二次電池の基本的な仕組みです。
以上、電池の仕組みと原理について説明しました。
特に二次電池は電気自動車の普及などでますます活躍が求められるものであり、仕組みを知っておいて損はないと思います。
