
前回の記事で「化学エネルギー」の基本的なイメージをお伝えしました。
今回は、原子や分子に蓄えられた化学エネルギーが放出される具体例として、物質の「燃焼」を説明してみます。
物質が燃焼するのに必要な物質の1つが「酸素」です。
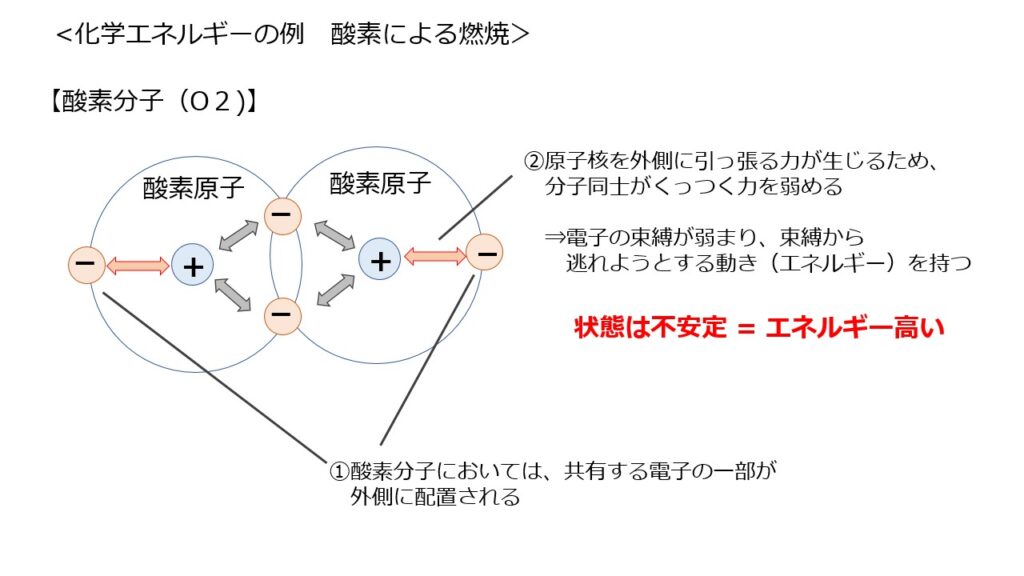
酸素は空気中に分子の状態で存在していますが、この酸素分子は「不安定」な状態です。
酸素分子が不安定な理由は「酸素分子においては、電子の一部が外側に配置されるため」とイメージしてください。
外側の電子に原子核が引っ張られることで、分子同士が離れようとする力を生みます。
その結果、中央の電子を束縛する力が弱まり、電子は束縛から逃れ、原子同士が離れようとする動き(エネルギー)を持っている状態、つまり、不安定でエネルギーが高い状態となっているわけです。
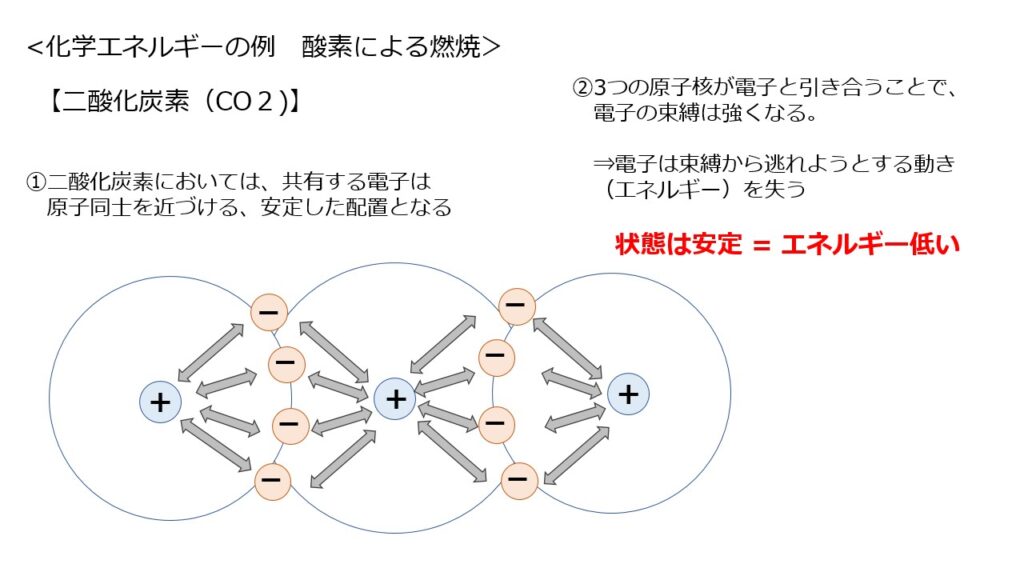
一方で酸素が燃えた後には「二酸化炭素」が生じます。
燃焼した後に生じる二酸化炭素は、電子はすべて原子同士を近づける安定した配置となります。
また、3つの原子核がそれぞれ電子と引き合うことで、強く束縛された状態となります。
結果として、電子は動き(エネルギー)をあまり持たないこととなります。
(=安定である、エネルギーが低い状態)
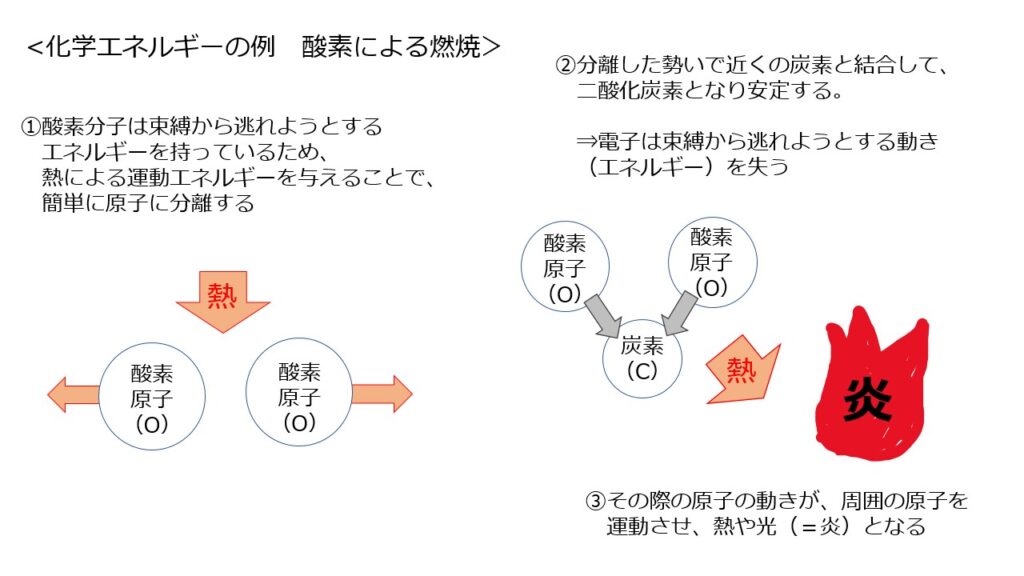
以上を踏まえて、燃焼の仕組みは以下の通りとなります。
<燃焼する仕組み>
①不安定な酸素分子に、外側から熱エネルギーを加えることで酸素分子の運動量は増え、簡単に2つの原子に分離する
②分離した後、近くの炭素と結合することで、安定した状態(二酸化炭素)となる
③炭素と結合するための原子の動きが周囲の原子を運動させ、それが熱や光(=炎)となる
以上、化学エネルギーが使われる具体例として、「燃焼」を説明しました。
念のため補足ですが、ここでは、極力イメージしやすい表現を使っており、
実際には科学的にはまだ不明確な点や、実際の状況とは異なる点もあることにご留意ください。

